NOMBRE DEL MEDICAMENTO
. Xolair 75 mg solución inyectable. Omalizumab.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
. Cada jeringa precargada de 0,5 ml de solución contiene 75 mg de omalizumab*.
*Omalizumab es un anticuerpo monoclonal humanizado obtenido mediante la tecnología del ADN recombinante, a partir de una línea celular mamífera de ovario de hámster chino (OHC). Para consultar la lista completa de
excipientes, ver sección “Lista de excipientes”.
fORMA fARMACÉUTICA
. Solución inyectable. Solución de transparente a opalescente, de color ligeramente amarillo a marrón.
DATOS CLÍNICOS
.
Indicaciones terapéuti-
cas.
Xolair está indicado en adultos, adolescentes y niños (de 6 a <12 años). El tratamiento con Xolair deberá ser considerado únicamente para pacientes con asma mediada de forma convincente por IgE (inmunoglobulina
E) (ver sección “Posología y forma de administración”). Adultos y adolescentes (a partir de 12 años de edad). Xolair está indicado para mejorar el control del asma cuando se administra como tratamiento adicional en
pacientes con asma alérgica grave persistente que presentan test cutáneo positivo o reactividad
in vitro
a aeroalergenos perennes y con función pulmonar reducida (FEV
1
<80%) así como, síntomas frecuentes durante
el día o despertares por la noche y que han presentado múltiples exacerbaciones asmáticas graves documentadas, a pesar de utilizar corticosteroides diarios inhalados a dosis altas, más un agonista beta2 inhalado de
larga duración. Niños (6 a <12 años de edad). Xolair está indicado para mejorar el control del asma cuando se administra como tratamiento adicional en pacientes con asma alérgica grave persistente que presentan test
cutáneo positivo o reactividad
in vitro
a aeroalergenos perennes y síntomas frecuentes durante el día o despertares por la noche y que han presentado múltiples exacerbaciones asmáticas graves documentadas, a pesar
de utilizar corticosteroides diarios inhalados a dosis altas, más un agonista beta2 inhalado de larga duración.
Posología y forma de administración
. El tratamiento con Xolair debe iniciarlo un médico experimentado en
el diagnóstico y tratamiento del asma grave persistente. Posología. La dosis apropiada y la frecuencia de administración de Xolair se determina a partir de la concentración basal de IgE (UI/ml), medida antes de iniciar el
tratamiento, y del peso corporal (kg). A efectos de la asignación de la dosis, antes de la administración de la dosis inicial se debe determinar la concentración de IgE en los pacientes mediante cualquier método comercial
que analice la IgE plasmática total. En base a estas determinaciones, podrán ser necesarios en cada administración de 75 a 600 mg de Xolair en 1 a 4 inyecciones. Era menos probable que experimentaran beneficio los
pacientes con un valor de IgE inferior a 76 UI/ml. Los médicos prescriptores deberán asegurar que los pacientes adultos y adolescentes con una IgE por debajo de 76 UI/ml y los niños (6 a < 12 años de edad) con una
IgE por debajo de 200 UI/ml presenten una reactividad
in vitro
inequívoca (RAST) al alergeno perenne antes de iniciar el tratamiento. Ver Tabla 1 de conversión y Tablas 2 y 3 para la determinación de dosis en adultos,
adolescentes y niños (de 6 a <12 años). No debe administrarse Xolair a pacientes cuya concentración basal de IgE o peso corporal en kilogramos, excedan los límites indicados en la tabla de dosis. La dosis máxima
recomendada es de 600 mg de omalizumab cada dos semanas.
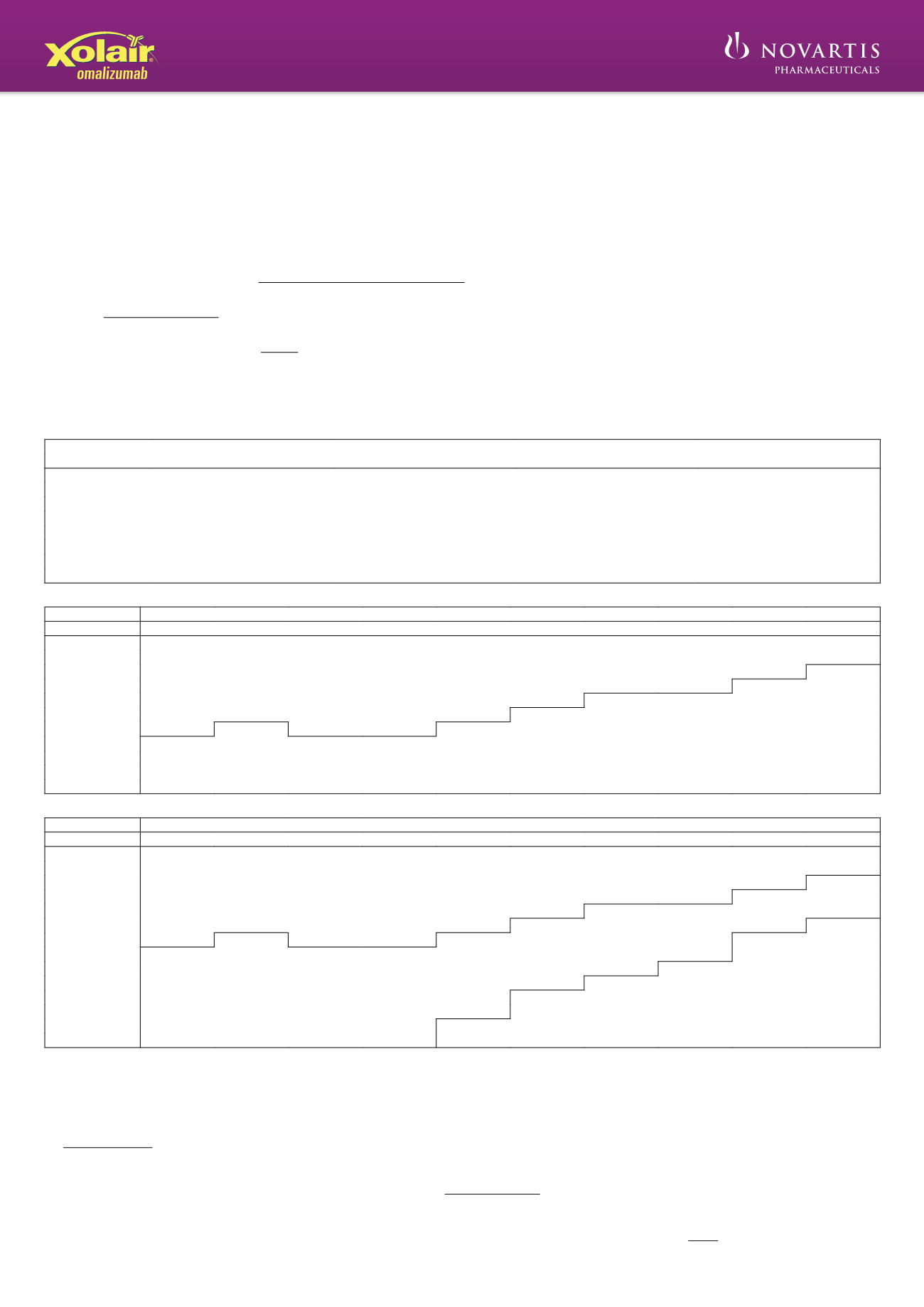
Tabla 1: Conversión de la dosis al número de jeringas, número de inyecciones y volumen de inyección total para cada administración.
Dosis (mg)
Número de jeringas
Número de inyecciones
Volumen total de inyección (ml)
75 mg
150 mg
75
1
0
1
0,5
150
0
1
1
1,0
225
1
1
2
1,5
300
0
2
2
2,0
375
1
2
3
2,5
450
0
3
3
3,0
525
1
3
4
3,5
600
0
4
4
4,0
Tabla 2: ADMINISTRACIÓN CADA 4 SEMANAS. Dosis de Xolair (miligramos por dosis) administrada por inyección subcutánea cada 4 semanas
Peso corporal (kg)
IgE basal (UI/ml)
≥
20‑25
>25‑30 >30‑40
>40‑50
>50‑60
>60‑70
>70‑80
>80‑90
>90‑125
>125‑150
≥
30‑100
75
75
75
150
150
150
150
150
300
300
>100‑200
150
150
150
300
300
300
300
300
450
600
>200‑300
150
150
225
300
300
450
450
450
600
>300‑400
225
225
300
450
450
450
600
600
>400‑500
225
300
450
450
600
600
>500‑600
300
300
450
600
600
>600‑700
300
450
600
>700‑800
>800‑900
ADMINISTRACIÓN CADA 2 SEMANAS
VER TABLA 3
>900‑1000
>1000‑1100
Tabla 3: ADMINSTRACIÓN CADA 2 SEMANAS. Dosis de Xolair (miligramos por dosis) administrada por inyección subcutánea cada 2 semanas
Peso corporal (kg)
IgE basal (UI/ml)
≥
20‑25
>25‑30
>30‑40
>40‑50
>50‑60
>60‑70
>70‑80
>80‑90
>90‑125
>125‑150
≥
30‑100
ADMINISTRACIÓN CADA 4 SEMANAS
VER TABLA 2
>100‑200
>200‑300
375
>300‑400
450
525
>400‑500
375
375
525
600
>500‑600
375
450
450
600
>600‑700
225
375
450
450
525
>700‑800
225
225
300
375
450
450
525
600
>800‑900
225
225
300
375
450
525
600
>900‑1000
225
300
375
450
525
600
>1000‑1100
225
300
375
450
600
>1100‑1200
300
300
450
525
600
NO ADMINISTRAR – no se dispone de datos para la recomendación de dosis
>1200‑1300
300
375
450
525
>1300‑1500
300
375
525
600
Duración del tratamiento, monitorización y ajuste de dosis.
Xolair está indicado para tratamiento a largo plazo. Los ensayos clínicos han demostrado que son necesarias un mínimo de 12‑16 semanas para que el trata‑
miento con Xolair demuestre efectividad. A las 16 semanas de iniciar el tratamiento con Xolair, los pacientes deberán ser evaluados por su médico con respecto a la efectividad del tratamiento antes de administrar inyec‑
ciones posteriores. La decisión de continuar con Xolair tras las 16 semanas, o en ocasiones posteriores, debe estar basada en si se observa una notable mejoría en el control global del asma. La interrupción del trata‑
miento con Xolair generalmente da lugar a un retorno de las concentraciones elevadas de IgE libre y de los síntomas asociados. Los valores de IgE total son elevados durante el tratamiento y siguen siéndolo hasta un año
después de la interrupción del mismo. Por lo tanto, no puede utilizarse la reevaluación de los valores de IgE durante el tratamiento con Xolair como guía para la determinación de la dosis. La determinación de la dosis tras
interrupciones de tratamiento de menos de un año de duración debe basarse en las concentraciones plasmáticas de IgE obtenidas en la determinación de dosis inicial. Si el tratamiento con Xolair se ha interrumpido por
más de un año deberán de volver a medirse las concentraciones plasmáticas de IgE total para la determinación de la dosis. Las dosis deberán ajustarse en caso de variaciones significativas del peso corporal (ver Tablas 2
y 3). Poblaciones especiales.
Pacientes de edad avanzada (mayores de 65 años).
Aunque se dispone de datos limitados sobre el uso de Xolair en pacientes mayores de 65 años, no existe evidencia de que los pacientes
de edad avanzada requieran una dosis diferente de la de pacientes adultos más jóvenes.
Insuficiencia renal o hepática.
No se dispone de estudios sobre el efecto de la insuficiencia renal o hepática en la farmacocinética
de Xolair. Debido a que el aclaramiento de omalizumab a dosis clínicas se lleva a cabo fundamentalmente por el sistema reticuloendotelial (SRE), es improbable que se vea alterado en caso de insuficiencia renal o hepá‑
tica. Xolair deberá administrarse con precaución en estos pacientes, mientras no se recomiende un ajuste especial de la dosis (ver sección “Advertencias y precaucionesespeciales de empleo”).
Población pediátrica.
No
se ha establecido la seguridad y eficacia de Xolair en niños menores de 6 años. No se dispone de datos. Forma de administración. Para administración subcutánea únicamente. No administrar por vía intravenosa o intra‑
muscular. Las inyecciones se administran vía subcutánea en la región deltoidea del brazo. Si por alguna razón no pueden administrarse en esta zona, podrán administrase alternativamente en el muslo. Existe experiencia
limitada con respecto a la autoadministración de Xolair. Por lo tanto, está previsto que el tratamiento sea administrado únicamente por el profesional sanitario. Para consultar las instrucciones de reconstitución del medi‑
camento antes de la administración, ver sección “Precauciones especiales de eliminación y otras manipulaciones” y también la sección “información para el profesional sanitario” del prospecto.
Contraindicaciones
.
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección “Lista de excipientes”.
Advertencias y precauciones especiales de empleo
. General. Xolair no está indicado para el tratamien‑
to de las exacerbaciones asmáticas, broncoespasmo o estados asmáticos de carácter agudo. No se ha estudiado el efecto de Xolair en pacientes con síndrome de hiperinmunoglobulinemia E o aspergilosis broncopulmo‑
nar alérgica, ni en la prevención de reacciones anafilácticas, incluyendo las provocadas por alergias alimentarias, dermatitis atópica, o rinitis alérgica. Xolair no está indicado en el tratamiento de estas patologías. El tra‑
REfERENCIAS: *
CI: corticosteroides inhalados; LABA: agonista ß2 de acción prolongada.
**
Todos estos estudios hacen referencia a pacientes de 12 años en adelante.
1.
Humbert M, Beasley R, Ayres J, et al. Benefits
of omalizumab as add‑on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy 2005;60:309‑16.
2.
Ayres
JG, Higgins B, Chilvers ER, et al. Efficacy and tolerability of anti‑immunoglobulin E therapy with omalizumab in patients with poorly controlled (moderate‑to‑severe) allergic asthma. Allergy 2004;59:701–8.
3.
Vignola AM,
Humbert M, Bousquet J, et al. Efficacy and tolerability of anti‑immunoglobulin E therapy with omalizumab in patients with concomitant allergic asthma and persistent allergic rhinitis (SOLAR). Allergy 2004;59:709–17.
4.
Busse W, Corren J, Lanier BQ, et al. Omalizumab, anti‑IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. Journal of Allergy and Clinical Immunology 2001;108:184–90.
5.
Solèr M,
Matz J, Townley R, et al. The anti‑IgE antibody omalizumab reduces exacerbations and steroid requirement in allergic asthmatics. European Respiratory Journal 2001;18:254–61. Erratum in: European Respiratory Journal
2001;18:739–40.
6.
Holgate ST, Chuchalin AG, Hébert J, et al. Efficacy and safety of a recombinant anti‑immunoglobulin E antibody (omalizumab) in severe allergic asthma. Clinical & Experimental Allergy 2004;34:632–8.


